RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Produodopa 240 mg/ml + 12 mg/ml solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 ml contient 240 mg de foslévodopa et 12 mg de foscarbidopa.
10 ml contiennent 2 400 mg de foslévodopa et 120 mg de foscarbidopa.
La foslévodopa et la foscarbidopa sont des promédicaments qui équivalent approximativement à 170 mg de lévodopa et 9 mg de carbidopa par 1 ml.
Excipient à effet notoire:
Produodopa contient environ 1,84 mmol (42,4 mg) de sodium par millilitre.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution pour perfusion (perfusion).
Produodopa est une solution claire à légèrement opalescente fournie dans un flacon en verre. La solution doit être exempte de particules. La couleur de Produodopa peut varier d’incolore à jaune au brun et peut présenter une teinte violette ou rouge. Les changements de couleur sont attendus et n’ont aucun impact sur la qualité du produit. La solution peut prendre une couleur plus foncée après avoir percé le bouchon du flacon ou lorsque la solution est dans la seringue.
Le pH est approximativement égal à 7,4. L’osmolalité est comprise entre 2 200 et 2 500 mOsmol/kg, mais peut atteindre 2 700 mOsmol/kg.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement de la maladie de Parkinson à un stade avancé et répondant à la lévodopa, avec des fluctuations motrices sévères et une hyperkinésie ou dyskinésie, lorsque les associations disponibles de médicaments antiparkinsoniens n’ont pas fourni de résultats satisfaisants.
4.2 Posologie et mode d’administration
Posologie
Produodopa est administré par perfusion sous‑cutanée continue, 24 heures sur 24.
Le débit de perfusion initial recommandé pour Produodopa est déterminé en convertissant la prise de lévodopa pendant la journée en équivalents lévodopa (EL), puis en l’augmentant pour prendre en compte une administration sur 24 heures (voir Instauration du traitement). La dose peut être ajustée pour obtenir une réponse clinique qui maximise le temps « On » fonctionnel et minimise le nombre et la durée des épisodes « Off » et des épisodes « On » avec dyskinésies gênantes. La dose quotidienne maximale de foslévodopa recommandée est de 6 000 mg (ou 25 ml de Produodopa par jour, équivalent à environ 4 260 mg de lévodopa par jour).
Produodopa remplace les médicaments contenant de la lévodopa et les inhibiteurs de la catéchol-o-méthyl-transférase (COMT). Si besoin, d’autres classes de médicaments pour traiter la maladie de Parkinson, peuvent être prises de façon concomitante.
Instauration du traitement
Les patients sélectionnés pour le traitement par Produodopa doivent être capables de comprendre et d’utiliser le système d’administration eux‑mêmes ou avec l’aide d’un soignant.
Les patients doivent être formés à l’utilisation correcte de Produodopa et du système d’administration (voir Mode d’administration) avant l’instauration du traitement par Produodopa et par la suite, si nécessaire.
Trois étapes sont requises pour instaurer le traitement par Produodopa.
- Étape 1: Calculez les EL en fonction des médicaments contenant de la lévodopa utilisés pendant la période éveillée du patient.
- Étape 2: Déterminez le débit horaire de perfusion de Produodopa.
- Étape 3: Déterminez le volume de la dose de charge.
Étape 1: Calculez les EL en fonction des médicaments contenant de la lévodopa utilisés pendant la période éveillée du patient.
La quantité de lévodopa de toutes les formulations, contenant de la lévodopa, utilisées pendant la période d’éveil en journée (généralement 16 heures par jour) doivent être converties en EL grâce au facteur de multiplication de la dose appropriée du tableau 1, puis additionnées. Pour ce calcul, seuls la lévodopa et les inhibiteurs de la COMT doivent être pris en compte. La lévodopa de secours ou tout autre médicament ou traitement de la maladie de Parkinson, y compris les médicaments pris en dehors de la période éveillée (par ex, administration nocturne), ne doivent pas être inclus dans ce calcul. Si des inhibiteurs de la COMT sont pris dans un délai de 24 heures, quelle que soit la dose, un facteur de correction doit être appliqué à la somme des EL, comme indiqué dans le tableau 1.
Tableau 1. Calcul des équivalents de la lévodopa (EL)
Formulation de lévodopa | Facteur de multiplication de la dose |
Libération immédiate, y compris la suspension entérale | 1 |
Libération prolongée, libération contrôlée ou libération continuea | 0,75 |
Si un inhibiteur de la COMT est utilisé, multipliez la somme des EL calculés ci‑dessus par1,33a | |
a La lévodopa contenue dans les formulations combinées de LD/CD/inhibiteur de la COMT est considérée comme libération immédiate et doit être ajoutée aux EL de toutes les autres sources de lévodopa avant de multiplier la somme par le facteur de correction des inhibiteurs de la COMT (c.‑à‑d. n’appliquez pas le facteur de correction à un seul EL). | |
Étape 2: Déterminez le débit horaire de la perfusion de Produodopa.
Reportez‑vous au tableau 2 pour les débits de perfusion initiaux selon les EL calculés à l’étape 1.
Le débit horaire de la perfusion de Produodopa indiqué dans le tableau 2 dépend de la prise de EL par le patient au cours d’une période éveillée généralement de 16 heures (EL16).
Si les EL déterminés à l’étape 1 étaient basés sur une période éveillée plus longue ou plus courte que 16 heures, les EL doivent être ajustés pour une période de 16 heures. Pour cela, divisez les EL calculés à l’étape 1 par le nombre d’heures pendant lesquelles le patient est généralement éveillé, puis multipliez par 16. Reportez‑vous ensuite au tableau 2 pour les débits de perfusion initiaux suggérés pour Produodopa. Une alternative consiste à calculer le débit de perfusion horaire initial selon la formule présentée sous le Tableau 2, où X est le nombre d’heures d’éveil par jour du patient.
Le débit horaire de perfusion déterminé lors de cette étape doit être saisi comme débit de perfusion de base lors de la programmation de la pompe (consultez le mode d’emploi de la pompe pour plus de détails).
Tableau 2. Suggestion de débit horaire de perfusion initial pour Produodopa
EL16 (Equivalents lévodopa de tous les médicaments par voie orale contenant de la lévodopa pris sur une période d'éveil de 16 heures (mg)) | Suggestion de débit horaire de perfusion initial pour Produodopa (ml/h)a administré sur 24 heures |
< 400 | 0,15 |
400‑499 | 0,15‑0,17 |
500‑599 | 0,17‑0,20 |
600‑699 | 0,20‑0,24 |
700‑799 | 0,24‑0,27 |
800‑899 | 0,27‑0,30 |
900‑999 | 0,30‑0,34 |
1 000‑1 099 | 0,34‑0,37 |
1 100‑1 199 | 0,37‑0,40 |
1 200‑1 299 | 0,40‑0,44 |
1 300‑1 399 | 0,44‑0,47 |
1 400‑1 499 | 0,47‑0,51 |
1 500‑1 599 | 0,51‑0,54 |
1 600‑1 699 | 0,54‑0,57 |
1 700‑1 799 | 0,57‑0,61 |
1 800‑1 899 | 0,61‑0,64 |
1 900‑1 999 | 0,64‑0,68 |
2 000‑2 099 | 0,68‑0,71 |
2 100‑2 199 | 0,71‑0,74 |
2 200‑2 299 | 0,74‑0,78 |
2 300‑2 399 | 0,78‑0,81 |
2 400‑2 499 | 0,81‑0,84 |
2 500‑2 599 | 0,84‑0,88 |
2 600‑2 699 | 0,88‑0,91 |
2 700‑2 799 | 0,91‑0,94 |
2 800‑2 899 | 0,94‑0,98 |
2 900‑2 999 | 0,98‑1,01 |
3 000‑3 099 | 1,01‑1,04 |
> 3 100 | 1,04 |
a Le débit horaire de perfusion peut être calculé à l’aide de la formule suivante, où X est le nombre d’heures pendant lesquelles le patient est éveillé, utilisé pour déterminer les EL (par ex., X = 16 dans le tableau ci‑dessus).
| |
Étape 3: Déterminez le volume de la dose de charge.
Une dose de charge peut être immédiatement administrée avant de commencer la perfusion afin d’obtenir rapidement le contrôle des symptômes lorsque le traitement par Produodopa est instauré à l’état « OFF » (ou si la pompe est éteinte depuis plus de 3 heures). Les doses de charge peuvent être administrées soit par l’intermédiaire de la pompe ou par voie orale à l’aide de comprimés de carbidopa‑lévodopa à libération immédiate.
Le tableau 3 indique le volume de la dose de charge de Produodopa recommandé (ml) devant être programmé dans la pompe (consultez le mode d’emploi de la pompe pour plus de détails) et la quantité correspondante de lévodopa à libération immédiate (mg), quel que soit l’inhibiteur de la dopa‑décarboxylase périphérique administré en association (par ex., carbidopa, bensérazide).
Tableau 3. Détermination du volume de Produodopa recommandé pour la dose de charge
Volume de la dose de charge recommandé (ml) devant être programmé dans la pompe | Quantité correspondante approximative de lévodopa (mg) |
0,6 | 100 |
0,9‑1,2 | 150‑200 |
1,5‑1,8 | 250‑300 |
2,0 | 350 |
0,1 ml de Produodopa contient 24 mg de foslévodopa (équivalent à environ 17 mg de lévodopa). La pompe est capable de fournir une dose de charge allant de 0,1 ml à 3,0 ml maximum, par paliers de 0,1 ml. | |
Optimisation et entretien
Le professionnel de santé peut ajuster le débit horaire de perfusion initial pour obtenir la réponse clinique optimale pour le patient. Le débit horaire de perfusion doit être administré en continu sur une période de perfusion quotidienne de 24 heures. Si souhaité, le professionnel de santé peut programmer et activer 2 débits horaire de perfusion différents (faible/élevé). Tous les débits de perfusion peuvent être ajustés par paliers de 0,01 ml/h (ce qui équivaut à environ 1,7 mg de lévodopa/heure) et ne doivent pas dépasser 1,04 ml/h (ou environ 4 260 mg de lévodopa par jour [6 000 mg de foslévodopa par jour]). La pompe intègre un accès sécurisé pour la configuration de la dose afin d’empêcher les patients d'apporter des modifications à leurs débits préprogrammés ou la fonctionnalité de dose supplémentaire.
Produodopa peut être pris seul ou, si besoin, avec d’autres médicaments concomitants pour le traitement de la maladie de Parkinson, selon l’avis du professionnel de santé. Une diminution des autres médicaments concomitants pour le traitement de la maladie de Parkinson, suivie d’un ajustement de la dose de Produodopa, peut être envisagée pendant la perfusion de Produodopa. L’utilisation concomitante de Produodopa avec d’autres médicaments contenant de la lévodopa ou d’autres médicaments régulant de manière significative les taux de dopamine synaptique (comme les inhibiteurs de la COMT) n’a pas été étudiée.
Débit alternatif
La pompe permet également de programmer 2 options de débit de perfusion alternatif (faible/élevé) pour une utilisation par le patient. Les débits de perfusion alternatifs doivent être activés et préprogrammés par le professionnel de santé et peuvent être sélectionnés par les patients pour répondre aux modifications des exigences fonctionnelles, par exemple, diminuer la dose la nuit ou augmenter la dose lors d’une activité intense prolongée (consultez le mode d’emploi de la pompe pour plus de détails).
Doses supplémentaires
Si le professionnel le permet, les patients peuvent s’administrer eux‑mêmes une dose supplémentaire pour gérer les symptômes « off » aigus pouvant apparaître pendant la perfusion continue. Le volume de la dose supplémentaire peut être sélectionné parmi 5 options (voir tableau 4). La fonction de dose supplémentaire est limitée à un maximum de 1 dose supplémentaire par heure. Dans le cas où 5 doses supplémentaires ou plus seraient utilisées par le patient pendant une période de traitement de 24 heures/une journée, une révision du débit de perfusion de base doit être envisagée. La capacité d’activer cette fonction, ainsi que le temps minimum requis entre les doses supplémentaires, est déterminée par le professionnel de santé et ne peut pas être modifiée par le patient (consultez le mode d’emploi de la pompe pour plus de détails sur la programmation de la fonction de dose supplémentaire).
Tableau 4. Option de dose supplémentaire de Produodopa
Volume de Produodopa | Équivalents de la lévodopa |
0,10 | 17 |
0,15 | 25.5 |
0,20 | 34 |
0,25 | 42.5 |
0,30 | 51 |
Mode d’administration
Produodopa est administré par voie sous‑cutanée, de préférence dans l’abdomen, en évitant une zone circulaire de 5 cm autour du nombril. Utilisez une technique aseptique lors de la préparation et de l’administration de ce produit. Le kit de perfusion (canule) peut rester en place pendant un maximum de 3 jours lors de la perfusion continue du médicament. Changez régulièrement le site de perfusion et utilisez un nouveau kit de perfusion au moins tous les 3 jours. Il est recommandé que les nouveaux sites de perfusion soient à 2,5 cm minimum des sites utilisés dans les 12 jours précédents. Le Produodopa ne doit pas être perfusé dans des zones où le site est sensible, contusionné, rouge ou induré. Utilisez uniquement la pompe Vyafuser pour l’administration de Produodopa (consultez le mode d’emploi de la pompe pour plus de détails) avec des composants pour perfusion stériles et à usage unique (seringue, kit de perfusion et adaptateur de flacon), approuvés pour utilisation. Les patients doivent être formés à l’utilisation correcte de Produodopa et du système d’administration (pompe, flacon de solution, adaptateur de flacon, seringue, kit de perfusion, accessoire de transport, batterie rechargeable et chargeur), avant l’instauration du traitement par Produodopa et par la suite, si nécessaire.
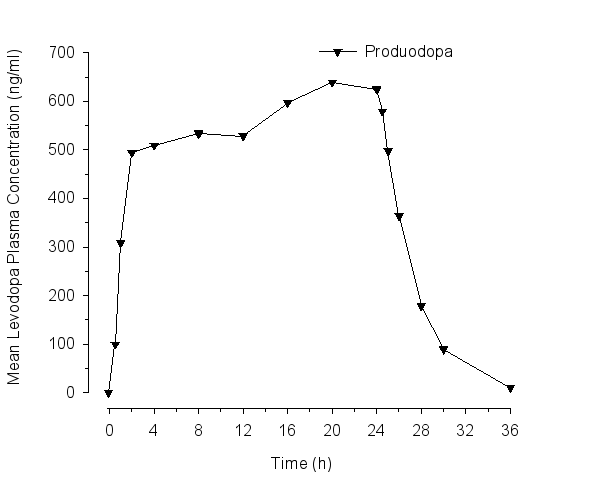
Dans une étude croisée de pharmacocinétique, l’administration de Produodopa dans le bras et dans la cuisse a généré une exposition presque équivalente à celle dans l’abdomen (voir rubrique 5.2 Absorption). La sécurité et l’efficacité à long terme de l’administration dans le bras et dans la cuisse n’ont pas été évaluées.
Le médicament doit être conservé et manipulé comme décrit dans la rubrique 6.4 Précautions particulières de conservation. Les flacons de médicament sont usage unique. Une fois que le contenu d’un flacon a été transféré dans la seringue, le contenu de la seringue doit être administré dans les 24 heures qui suivent. Les flacons de médicaments et seringues usagés doivent être éliminés conformément aux réglementations locales. Les seringues doivent être jetées, même en présence de produit résiduel, conformément aux directives du professionnel de santé (voir rubrique 6.6 Précautions particulières d’élimination).
Interruption du traitement
Il est préférable d’éviter l’interruption soudaine ou la réduction rapide des doses de Produodopa sans l’administration d’un autre traitement dopaminergique (voir rubrique 4.4).
Produodopa peut être interrompu sans prendre d’autres mesures pendant de courtes périodes, par exemple lorsque vous prenez une douche. Pour les interruptions de plus d’une heure, un nouveau kit de perfusion (tubulure et canule) doit être utilisé sur un autre site de perfusion. En cas d’interruption de la perfusion pendant plus de 3 heures, le patient peut également s’administrer lui‑même une dose de charge, si cette fonction a été activée par le professionnel de santé, afin de rétablir rapidement le contrôle des symptômes.
Si le traitement par Produodopa est interrompu pendant une longue période (> 24 heures) ou de façon permanente, le professionnel de santé doit décider d’un autre traitement dopaminergique approprié (par ex., lévodopa/carbidopa par voie orale). Le traitement par Produodopa peut reprendre à tout moment en suivant les mêmes instructions que pour l’instauration du traitement (voir rubrique 4.2 Instauration du traitement).
Populations particulières
La pharmacocinétique de Produodopa n’a été évaluée dans aucune population particulière. Produodopa est destiné à être utilisé chez les patients atteints de la maladie de Parkinson et recevant déjà une dose stable de lévodopa par voie orale. Les différences d’exposition ne sont pas considérées comme cliniquement significatives, car Produodopa est optimisé une fois que les patients commencent le traitement. Les effets des covariables ne devraient donc pas avoir d’incidence sur l’efficacité et la sécurité cliniques. Voir la rubrique 5.2 pour plus d’informations sur la pharmacocinétique de la lévodopa et de la carbidopa dans les populations particulières.
4.3 Contre‑indications
Produodopa est contre‑indiqué chez les patients ayant:
- hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
- glaucome à angle fermé
- insuffisance cardiaque sévère
- accident vasculaire cérébral aigu
- arythmie cardiaque sévère
- Les inhibiteurs non sélectifs de la MAO et les inhibiteurs sélectifs de la MAO‑A sont contre‑indiqués avec Produodopa. Ces inhibiteurs doivent être arrêtés au moins deux semaines avant l’instauration du traitement par Produodopa. Produodopa peut être administré en même temps que la dose recommandée par le fabricant d’un inhibiteur sélectif de la MAO‑B (par exemple le chlorhydrate de sélégiline) (voir rubrique 4.5).
- contre‑indications aux adrénergiques, par exemple: phéochromocytome, hyperthyroïdie, syndrome de Cushing.
Comme la lévodopa peut activer un mélanome malin, Produodopa ne doit pas être utilisé chez les patients présentant des lésions cutanées suspectes non diagnostiquées ou des antécédents de mélanome.
4.8 Effets indésirables
Résumé du profil de sécurité
Les effets indésirables les plus fréquents (≥ 10 %) rapportés dans l’ensemble des études de phase III chez les patients exposés à Produodopa, étaient les événements liés au site de perfusion (érythème au site de perfusion, cellulite au site de perfusion, nodule au site de perfusion, douleur au site de perfusion, œdème au site de perfusion, réaction au site de perfusion et infection au site de perfusion), les hallucinations, les chutes et l’anxiété.
Liste tabulée des effets indésirables
Les effets indésirables rapportés dans l’ensemble des études de phase III chez les patients exposés à Produodopa (379 patients avec une exposition totale de 414, 3 personne-années, 230 patients exposés pendant au moins 6 mois, 204 patients exposés pendant au moins 12 mois) ou issus des données pour Duodopa gel intestinal en fonction des fréquences de survenue au cours du traitement, quelle que soit la cause attribuée, sont présentées dans le tableau 5, classées par classe de systèmes d’organes selon MedDRA. Les fréquences des réactions indésirables est définie selon la convention suivante: très fréquent (≥ 1/10); fréquent (≥ 1/100, < 1/10); peu fréquent (≥ 1/1 000, < 1/100); rare (≥ 1/10 000, < 1/1 000); très rare (< 1/10 000).
Tableau 5. Liste des effets indésirables
Classe de systèmes d’organes | Fréquence | Effets indésirables |
Infections et infestations | Très fréquent | Cellulite au site de perfusion |
Fréquenta | Abcès au site de perfusion | |
Affections hématologiques et du système lymphatique | Fréquent | Anémieb |
Peu fréquent | Leucopénieb | |
Affections du système immunitaire | Fréquence indéterminée | Réaction anaphylactiqueb,e |
Troubles du métabolisme et de la nutrition | Fréquent | Perte de l’appétit |
Affections psychiatriques | Très fréquent | Anxiété |
Fréquent | Rêves anormauxb | |
Peu fréquent | Suicide accomplib | |
Rare | Pensées anormalesb | |
Affections du système nerveux | Fréquent | Troubles cognitifs |
| Peu fréquent | Ataxieb |
Affections oculaires | Peu fréquent | Glaucome à angle ferméb |
Affections cardiaques | Fréquent | Fréquence cardiaque irrégulièreb |
Peu fréquent | Palpitations | |
Affections vasculaires | Fréquent | Hypertension |
Peu fréquent | Phlébiteb | |
Affections respiratoires, thoraciques et médiastinales | Fréquent | Dyspnée |
Peu fréquent | Dysphonieb | |
Rare | Respiration anormaleb | |
Affections gastro‑intestinales | Fréquent | Distension abdominaleb |
Peu fréquent | Hypersécrétion salivaireb | |
Rare | Bruxismeb | |
Affections de la peau et du tissu sous‑cutané | Fréquent | Dermatite de contactb |
Peu fréquent | Alopécieb | |
Rare | Altération de la couleur de la sueurb | |
Affections musculosquelettiques et du tissu conjonctif | Fréquent | Spasmes musculaires |
Affections du rein et des voies urinaires | Fréquent | Incontinence urinaire |
Peu fréquent | Chromaturieb | |
Rare | Priapismeb | |
Troubles généraux et anomalies au site d’administration | Très fréquent | Érythème du site de perfusion |
Fréquenta | Asthénie | |
Peu fréquent | Douleur thoraciqueb | |
Investigations | Fréquent | Augmentation du taux d’acides aminés (augmentation de l’acide méthylmalonique) b |
Lésions, intoxications et complications d’interventions | Très fréquent | Chute |
a Effets indésirables fréquents relatives aux événements liés au site de perfusion, y compris si ≥ 2 %. | ||
Description de certains effets indésirables
Evénements au site de perfusion
Dans les études de phase III, les événements indésirables les plus fréquents liés à Produodopa étaient des réactions au site de perfusion (77,6 %, N = 294) et des infections au site de perfusion (41,4 %, N = 157). Des effets au site de perfusion, notamment des réactions et infections au site de perfusion se manifestant couramment lors des perfusions sous‑cutanées, ont été observés dans le cadre d’études cliniques portant sur Produodopa. La majorité de ces effets au site de perfusion étaient sans gravité, de sévérité légère à modérée, et ont été réglés spontanément ou à l’aide d’un traitement tel que des antibiotiques et/ou l’incision et le drainage. Trois sujets souffrant d’infections au site de perfusion ont présenté des complications de septicémie nécessitant une hospitalisation. Surveillez les changements cutanés au niveau du site de perfusion qui pourraient indiquer une éventuelle infection, comme une rougeur associée à une sensation de chaud, un gonflement, une douleur ou une décoloration lorsque vous appliquez une pression dessus. Il est conseillé d’utiliser des techniques aseptiques lors de l’utilisation de ce médicament et d’envisager de changer le site de perfusion plus souvent que tous les 3 jours, en utilisant un nouveau kit de perfusion si vous observez ces changements cutanés. Il est recommandé que les nouveaux sites de perfusion soient à 2,5 cm minimum des sites utilisés dans les 12 jours précédents.
Examens biologiques: Les anomalies biologiques suivantes ont été notifiées avec un traitement par la lévodopa/carbidopa, et doivent par conséquent être prises en considération lors du traitement des patients par Produodopa: augmentation de l’azote uréique, des phosphatases alcalines, de l’ASAT, de l’ALAT, de la LDH, de la bilirubine, de la glycémie, de la créatinine, de l’acide urique, test de Coombs positif, et diminution des valeurs de l’hémoglobine et de l’hématocrite. La présence de leucocytes, de bactéries et de sang dans l’urine a été notifiée. L’association lévodopa/carbidopa, et par conséquent Produodopa, peut provoquer un résultat faux positif lorsque les cétones urinaires sont testées à l’aide d’une bandelette urinaire; cette réaction n’est pas modifiée en portant l’échantillon d’urine à ébullition. L’utilisation des méthodes basées sur la glucose oxydase peut donner des résultats faux négatifs pour la glycosurie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via :
Belgique
Agence fédérale des médicaments et des produits de santé
Division Vigilance
Boîte Postale 97
B-1000 BRUXELLES Madou
Site internet: www.notifieruneffetindesirable.be
e-mail: adr@afmps.be
Luxembourg
Centre Régional de Pharmacovigilance de Nancy ou Division de la pharmacie et des médicaments de la Direction de la santé
Site internet : www.guichet.lu/pharmacovigilance
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Abbvie S.A.
Avenue Einstein 14
1300 Wavre
Belgique
8. NUMÉRO(S) D’AUTORISATION DE MISE SUR LE MARCHE
BE : BE660571
LU : 2022110244
- 0937921 (1x7 flacons 10 ml)
10. DATE DE MISE A JOUR DU TEXTE
Date d’approbation: 08/2025
PRIX
| Code CNK | Emballage | Code ATC5 | Prix | Prix ex-usine | Sur prescription | Ticket modérateur intervention régulière | Ticket modérateur intervention majorée |
|---|---|---|---|---|---|---|---|
| 4654141 | Produodopa 240mg/ml + 12mg/ml solution pour perfusion | - | € 691 | Oui | - | - |